
Elementos Químicos: Descubriendo los Bloques Fundamentales de la Materia
Los elementos químicos son las sustancias más básicas y fundamentales de la materia. Comprenderlos es esencial para adentrarse en el mundo de la química y la ciencia en general. En esta guía educativa, exploraremos en profundidad los elementos químicos, sus propiedades, historia, clasificación, y su importancia en nuestra vida cotidiana.

¿Qué son los Elementos Químicos?
Los elementos químicos son sustancias puras y fundamentales que conforman la materia en el universo. Cada elemento químico está compuesto por átomos idénticos, lo que significa que todos los átomos de un elemento en particular tienen la misma cantidad de protones en su núcleo. Estos elementos no pueden descomponerse en sustancias más simples mediante reacciones químicas ordinarias. En otras palabras, son las unidades más simples y básicas de la materia.
Históricamente, los elementos químicos se han definido por su número atómico, que es la cantidad de protones en el núcleo de un átomo de ese elemento. Cada elemento tiene un número atómico único que lo distingue de los demás elementos.
Cada elemento químico tiene sus propias propiedades físicas y químicas únicas, lo que significa que exhiben comportamientos característicos en reacciones químicas y tienen propiedades distintivas, como su punto de fusión, punto de ebullición, densidad, conductividad eléctrica, entre otras. Estas propiedades únicas hacen que los elementos químicos sean esenciales para comprender y manipular la materia en la química y otras ciencias relacionadas.
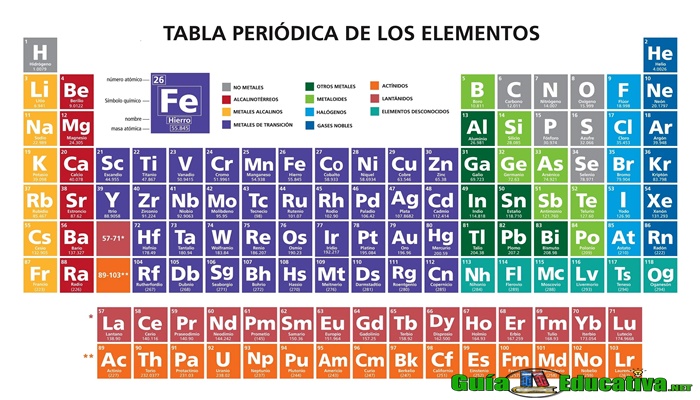
La tabla periódica de los elementos es una herramienta fundamental en la química que organiza todos los elementos químicos conocidos en función de sus propiedades y estructura electrónica. Esto permite una fácil identificación y comprensión de las relaciones entre los elementos y sus propiedades.
Historia de los Elementos Químicos
La historia de los elementos químicos es una narrativa fascinante que abarca miles de años y ha involucrado a científicos, filósofos y alquimistas de diferentes épocas y culturas. Aquí, exploraremos los hitos más importantes en la historia de los elementos químicos:
Filosofía Antigua:
- Empédocles (circa 490-430 a.C.): Este filósofo griego propuso que la materia estaba compuesta por cuatro elementos fundamentales: tierra, agua, aire y fuego. Creía que la combinación y separación de estos elementos explicaba todos los fenómenos naturales.
- Demócrito (circa 460-370 a.C.): Demócrito fue uno de los primeros en postular la existencia de átomos, partículas indivisibles que formaban la materia.
Alquimia Medieval:
Durante la Edad Media, la alquimia desempeñó un papel crucial en la historia de los elementos químicos. Los alquimistas buscaban la transmutación de metales en oro y la creación de la "piedra filosofal". A pesar de su enfoque en la magia y la espiritualidad, la alquimia contribuyó al desarrollo de la química.
Siglo XVIII:
- Antoine Lavoisier (1743-1794): Lavoisier, conocido como el "padre de la química moderna", introdujo la Ley de Conservación de la Masa y propuso una nomenclatura química sistemática. Sus experimentos rigurosos sentaron las bases para la comprensión de los elementos químicos.
Siglo XIX:
- Dmitri Mendeléyev (1834-1907): Mendeléyev fue un químico ruso que desarrolló la tabla periódica de los elementos en 1869. Organizó los elementos en función de sus propiedades y peso atómico, y predijo la existencia de elementos aún no descubiertos.
Siglo XX:
- Descubrimiento de Nuevos Elementos: A lo largo del siglo XX, se descubrieron numerosos elementos nuevos, como el radio, el plutonio y el neptunio. Estos elementos se crearon artificialmente en laboratorios mediante la fusión de núcleos atómicos.
Era Contemporánea:
-
Química Cuántica: El avance en la química cuántica y la teoría atómica en el siglo XX permitió una comprensión más profunda de la estructura electrónica de los átomos y, por lo tanto, de los elementos químicos.
-
Síntesis y Aplicaciones: Los elementos químicos tienen aplicaciones vitales en diversas industrias, desde la medicina y la energía hasta la tecnología. La síntesis y manipulación de elementos se ha vuelto esencial en la ciencia y la tecnología modernas.
Hoy en día, la investigación y la síntesis de nuevos elementos químicos continúan siendo áreas activas de estudio en la química. La historia de los elementos químicos es un testimonio de la curiosidad humana y la búsqueda constante de comprender y controlar el mundo que nos rodea a través de la ciencia.
Propiedades de los Elementos Químicos
Los elementos químicos exhiben una amplia variedad de propiedades que son características de cada elemento y que los distinguen unos de otros. Estas propiedades son fundamentales para comprender y clasificar los elementos en la tabla periódica. A continuación, se detallan algunas de las propiedades más importantes de los elementos químicos:
-
Número Atómico (Z): El número atómico es una propiedad única de cada elemento y representa la cantidad de protones en el núcleo de un átomo de ese elemento. Determina la identidad del elemento y su posición en la tabla periódica. Los elementos están ordenados en la tabla periódica de manera ascendente según su número atómico.
-
Masa Atómica (A): La masa atómica es la masa promedio de los átomos de un elemento en unidades de masa atómica (uma o u). A menudo, se redondea al número entero más cercano. La masa atómica se calcula teniendo en cuenta la abundancia de los isótopos de ese elemento.
-
Configuración Electrónica: La configuración electrónica de un elemento describe cómo se distribuyen sus electrones en los diferentes niveles y subniveles de energía alrededor del núcleo. Esto tiene un gran impacto en las propiedades químicas y el comportamiento de los elementos.
-
Estado Físico a Temperatura Ambiente: Los elementos pueden existir en diferentes estados físicos a temperatura ambiente: sólido, líquido o gas. Por ejemplo, el oxígeno es un gas, el hierro es un sólido y el mercurio es un líquido a temperatura ambiente.
-
Punto de Fusión y Punto de Ebullición: Estas son las temperaturas a las cuales un elemento cambia de estado físico. El punto de fusión es la temperatura a la que un sólido se convierte en líquido, y el punto de ebullición es la temperatura a la que un líquido se convierte en gas. Estas propiedades son útiles en la industria y la ciencia de materiales.
-
Densidad: La densidad es la masa de un elemento por unidad de volumen. Es una propiedad importante para determinar la flotabilidad y la compresibilidad de los elementos.
-
Conductividad Eléctrica y Térmica: Algunos elementos, como los metales, son buenos conductores de electricidad y calor debido a su estructura de electrones. Otros, como los no metales, son malos conductores (aislantes).
-
Reactividad Química: La reactividad de un elemento se refiere a su tendencia a participar en reacciones químicas. Algunos elementos son altamente reactivos, como el sodio, que reacciona violentamente con el agua, mientras que otros son inertes, como los gases nobles, que son muy estables y no reactivos.
-
Radio Atómico: El radio atómico es la medida del tamaño de un átomo. Por lo general, se expresa en picómetros (pm) o Ångströms (Å). Los átomos más grandes tienen radios atómicos más grandes.
-
Electronegatividad: La electronegatividad es la capacidad de un átomo para atraer electrones en una molécula. Los elementos con alta electronegatividad tienden a atraer electrones con fuerza, lo que influye en la formación de enlaces químicos.
Clasificación de los Elementos Químicos
Importancia de los Elementos Químicos en la Vida Cotidiana
Los elementos químicos desempeñan un papel fundamental en la vida cotidiana de las personas y en numerosos aspectos de la sociedad moderna. Su presencia y uso son omnipresentes, y afectan prácticamente todos los aspectos de nuestra vida. A continuación, se exploran algunas de las áreas más destacadas donde los elementos químicos son de vital importancia en nuestra vida cotidiana:
Salud y Medicina:
-
Oxígeno (O): El oxígeno es esencial para la respiración celular y la supervivencia humana. Se utiliza en la administración de oxígeno en hospitales y en la terapia de oxígeno.
-
Calcio (Ca), Hierro (Fe), Potasio (K): Estos elementos son esenciales para la salud humana y se encuentran en muchos alimentos y suplementos vitamínicos. El calcio es necesario para la salud de los huesos, el hierro para la producción de hemoglobina y el potasio para el funcionamiento de los músculos y nervios.
-
Yodo (I): El yodo se utiliza en la producción de hormonas tiroideas, y su deficiencia puede causar problemas de tiroides.
Energía:
-
Petróleo (Hidrocarburos): Los hidrocarburos del petróleo son la fuente de combustible predominante para vehículos y maquinaria.
-
Carbón (C): Aunque su uso ha disminuido en la generación de energía, el carbón todavía se utiliza en algunas plantas eléctricas y en la industria del acero.
-
Uranio (U): El uranio se utiliza en la generación de energía nuclear en centrales nucleares.
Industria:
-
Aluminio (Al), Hierro (Fe), Cobre (Cu): Estos metales son esenciales en la construcción, la fabricación de vehículos, la electrónica y una amplia gama de productos industriales.
-
Silicio (Si): El silicio se utiliza en la producción de chips de computadora y dispositivos electrónicos.
-
Plásticos (Carbono y Hidrógeno): Los plásticos se fabrican a partir de hidrocarburos y tienen aplicaciones en envases, construcción, productos de consumo y más.
Tecnología y Electrónica:
- Silicio (Si): El silicio es el material fundamental en la industria de la electrónica y es esencial para la fabricación de chips de computadora y dispositivos semiconductores.
- Cobre (Cu), Oro (Au): Estos elementos se utilizan en la fabricación de cables y componentes electrónicos.
Agricultura:
- Nitrógeno (N), Fósforo (P), Potasio (K): Estos elementos son componentes clave de los fertilizantes y son esenciales para la agricultura moderna y la producción de alimentos.
Medio Ambiente:
- Carbono (C), Nitrógeno (N), Oxígeno (O): Estos elementos están involucrados en los ciclos biogeoquímicos y son fundamentales para la salud del medio ambiente y la biodiversidad.
Alimentación y Cocina:
-
Sodio (Na), Cloro (Cl): La sal de mesa, compuesta de sodio y cloro, es un condimento común en la cocina.
-
Hierro (Fe): Las ollas y sartenes de hierro fundido son populares en la cocina debido a su capacidad para retener y distribuir el calor de manera uniforme.
Descubrimiento de Nuevos Elementos
El proceso de descubrimiento de nuevos elementos químicos es un campo activo de investigación en la química. Estos elementos se crean artificialmente en laboratorios a través de la fusión de átomos pesados. El último elemento descubierto en mi conocimiento es el Nihonio (Nh), con número atómico 113.
Conclusión
Los elementos químicos son los bloques fundamentales de la materia y desempeñan un papel esencial en todos los aspectos de nuestra vida. Desde su historia hasta sus propiedades y clasificación, comprender los elementos químicos es esencial para apreciar el mundo de la química y la ciencia en general. A medida que la investigación avanza, es posible que sigamos descubriendo nuevos elementos y expandiendo nuestro conocimiento sobre estos componentes esenciales de la materia.
Deja una respuesta


También Te Puede Interesar: